细胞保护DNA免受各种类型的损伤,如核苷酸碱基修饰、DNA- RNA杂交以及单链和双链断裂。DNA双链断裂具有高度破坏性,可导致染色体区域丢失,最终导致细胞死亡。修复双链断裂和维持基因组稳定性主要有两种途径,即非同源DNA末端连接和同源重组。DNA损伤因子poly (ADP) 核糖(PAR)聚合酶1(PARP1),可以检测DNA损伤并启动修复途径,起着至关重要的作用。PARP1和其它DNA损伤成分高度集中在DNA损伤处,并与DNA损伤位点的组装有关。但DNA双链断裂(DSB)在DSB位点修复,DSB位点是如何组装的,断裂的DNA又是如何阻止分离的,目前在分子层面还缺乏全面的认识。
2024年2月5日,德国德累斯顿工业大学Simon Alberti团队在Cell期刊上发表题为 PARP1-DNA co-condensation drives DNA repair site assembly to prevent disjunction of broken DNA ends 的研究论文,证明了DSB位点是通过PARP1多聚体与DNA的共凝聚形成的。共凝聚物施加机械力使DNA末端保持在一起,并成为合成PAR的酶活性。PAR修饰可促进DNA末端释放PARP1和招募效应蛋白,从而稳定断裂的DNA末端,防止其分离。本研究结果为DSB凝聚物的分级组装提供了一个全面的模型,以解释DNA末端连接和DNA损伤修复效应蛋白的募集。

在细胞中,PARP1定位于细胞核,浓度达到10-20 μM,使其成为一种高度丰富的核蛋白。某些DNA损伤可诱导PARP1聚集,作者在体外观察到1个PARP1分子可以结合21 bp的双链DNA,大约1 ~ 2个PARP1分子可以结合45 bp的双链DNA,大约3个PARP1分子可以结合100 bp的双链DNA。相反,同源的PARP2不与双链DNA形成凝聚物。单链(ss)DNA、ssRNA和dsRNA不促进凝聚物组装。PARP1和DNA在凝聚物内表现出缓慢的动力学,表明PARP1-dsDNA凝聚物通过可逆的相互作用而稳定。
同时阻断3′ 和5′ DNA末端可防止凝聚组装,阻断一条DNA链的5' 端和3' 端可减少部分凝聚,表明PARP1必须与两条DNA链相互作用。阻断两条DNA链的5'端也会损害凝聚物的组装,表明凝聚物是通过PARP1分别与5'端和3'端相互作用而稳定的。
作者证明了PARP1与损伤DNA共凝聚来介导断裂DNA末端的连接。具体机制上,初始步骤由PARP1蛋白的ZnF结构域和WGR结构域之间的分子间相互作用驱动以稳定PARP1二聚体,然后由DNA结合PARP1分子之间的ZnF3和BRCT结构域介导的分子间蛋白质-蛋白质相互作用组装成PARP1-DNA共凝聚体。这些分子间的相互作用发挥平衡的双向凝聚力,以防止DNA末端的分离。PARP1-DNA 共凝聚与PARP1激活同时发生,并在空间上限制PAR在损伤部位的合成。PAR聚合物募集效应蛋白,如FET蛋白和poly (ADP) 核糖-糖水解酶(PARG),并介导PARP1从DNA末端释放来启动凝聚物进行修复。FET蛋白募集到已激活的凝聚物防止凝聚物溶解并促进凝聚物状态从刚性到动态的转变,为FET蛋白的凝聚特性提供了功能作用。本研究的发现为断裂的DNA末端如何保持空间连接提供了一种分子和物理机制,同时允许修复因子进入。
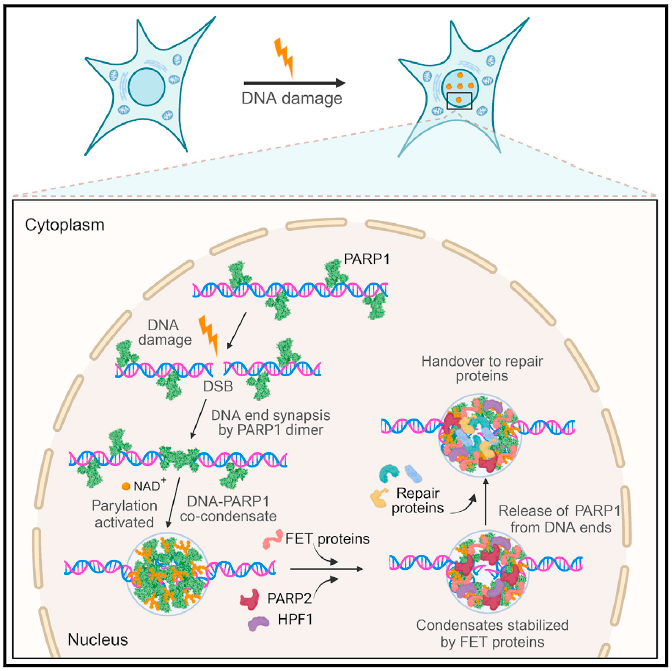
PARP1-DNA共凝聚驱动断裂DNA修复机制示意图
总而言之,本研究阐明了PARP1与DNA在DNA断裂处共凝聚,使断裂的DNA末端连接在一起,促进了修复蛋白的组装。目前,PARP抑制剂通过合成致死机制已用于临床治疗癌症,这与PARP1-dsDNA共凝聚物机制相对应。因此,本研究更全面地了解PARP1抑制剂如何调节DNA损伤凝聚物将有助于开发更好的癌症治疗方法。
原文链接:
https://doi.org/10.1016/j.cell.2024.01.015













